
Метаболизм холина у высокопродуктивных молочных коров: основы физиологии и кормления
Метаболизм холина у высокопродуктивных молочных коров:
основы физиологии и кормления
- A. Baldi and L. Pinotti1
Department of Veterinary Sciences and Technology for Food Safety,
University of Milan, Via Trentacoste 2, 20134 Milan, Italy. Получено 6 июля 2005, принято 8 февраля 2006.
Baldi, A. and Pinotti, L. 2006. Метаболизм холина у высокопродуктивных молочных коров: основы физиологии и кормления. Can. J. Anim. Sci. 86: 207–212. Холин, ион бета-гидроксиэтилтриметиламмония, является сильным основанием, содержащим триметилированный четвертичный азот. Холин присутствует во многих биологических материалах в качестве исходного соединения, ацетилхолина и различных фосфолипидов. В кормах и источниках сырого жира, холин в основном находится в виде фосфатидилхолина (лецитина). Несмотря на то, что соя, соевая мука, рапсовая мука, рыбная мука и сухие дрожжи являются довольно богатыми источниками холина, его биодоступность в них не высокая. У молочного скота основной распад холина происходит в рубце. Из-за этого в ткани организма попадает только незначительные количества поступившего с кормом холина. Что является причиной умеренного метаболизма метильных групп при относительно низком их катаболизме и повышенном уровне синтеза метильных групп через систему тетрагидрофолата. Прекурсорами глюконеогенеза являются первичные источники новых метильных групп. В зависимости от энергетического баланса и физиологического состояния у жвачных может быть дефицит этих прекурсоров. При дисбалансе глюкозы, например, в начале лактации молочных коров, в связи с повышенной необходимостью метильных групп, холин может стать лимитирующим при выработке молока. Кроме того, холин, являясь липотропным веществом, влияет на баланс жира в печени, таким образом улучшая метаболизм жиров в целом. Рассматриваемые в настоящей статье данные, соответствуют предположениям и утверждениям, что введение холина (в форме, защищающей его от распада в рубце) в рационы молочных коров может способствовать улучшению матаболизма метильных групп и других питательных веществ, включая витамин Е.
Холин, ион бета-гидроксиэтилтриметиламмония, является сильным основанием, содержащим триметилированный четвертичный азот. Холин присутствует во многих биологических материалах в качестве исходного соединения, ацетилхолина и различных фосфолипидов (Kuksis and Mookerjea 1978). Холин часто называют витамином; однако, в отличие от классических витаминов, он может синтезироваться в организме, а синдром дефицита холина у здоровых млекопитающих выявить зачастую невозможно (Zeisel 1988; Scott 1999). Новоситез холина происходит в результате последовательного метилирования фосфатидилэтаноламина, с использованием метильных групп S-аденозил-L-метионина (SAM) (Mato et al. 1994; Zeisel 1988, 1992). Однако, существование этого процесса не означает, что не требуется поступления холина извне; дефицит холина в корме, при недостатке других питательных веществ, приводит к множественным нарушениям (Zeisel et al. 1991). Например, отсутствие холина может привести к жировому перерождению печени, нарушению жирового обмена; в этом случае, холин рассматривается как липотропный фактор.
Наличие в кормах холина, метионина, бетаина, фолиевой кислоты и витамина В12 удовлетворяют потребности организма в холине. Взаимосвязь этих веществ обусловливается их участием в метаболизме метила, где двумя основными донорами метильных групп являются бетаин, метаболит холина, и SAM, метаболит метионина. Необходимость холина в качестве донора метильных групп вероятно является основным фактором, определяющим скорость проявления заболеваний при его дефиците (Zeisel et al. 1991).
Однако, метильные группы в организме могут синтезироваться в системе тетрагидрофолата (THF) (Zeisel 1992); участие этих групп в цикле метилирования требует присутствия витамина В12 (Kennedy et al. 1995; Scott 1999). Поэтому, при недостатке в рационах млекопитающих метионина и фолиевой кислоты, холин является жизненно важным питательным веществом (Zeisel et al. 1991; Zeisel 2000).
Метаболизм холина и метильных групп у жвачных отличается от других млекопитающих. У взрослых жвачных, основной распад холина происходит в рубце; таким образом в организм попадают только незначительные его количества. Умеренный метаболизм метильных групп с относительно низким их катаболизмом и повышенном уровне синтеза метильных групп через систему THF. У молочного скота, доступность поступившего с кормом холина низкая, в то время как выделение метилированных соединений с молоком высокое. Это говорит о том, что организму коров, особенно в начале лактации, требуется большее количество метионина и других источников метильных групп.
ДОПОЛНИТЕЛЬНЫЕ И ЕСТЕСТВЕННЫЕ ИСТОЧНИКИ ХОЛИНА
Свободный холин, ацетилхолин и холин-содержащие фосфолипиды в больших количествах присутствуют в растениях и тканях животных, а также в кормах, полученных на их основе (Pinotti et al. 2002). В составляющих корма и источниках сырого жира, холин присутствует в форме фосфатидилхолина (лицитина), в то время как кормовые добавки содержат холин хлорид (87% холина). Холин хлорид гигроскопичен, из-за чего его принято считать «стрессовым агентом» для других питательных веществ, входящих в состав витаминно-минеральных премиксов (Baker 1995).
Большая часть как натурального холина, содержащегося в кормах (в основном лецитин), и холина хлорида подвергается распаду в рубце [Sharma and Erdman 1989a; National Research Council (2001)]. Это приводит к незначительной доступности холина для всасывания в кишечнике (Dawson et al. 1981; Neill et al. 1978; Neill et al. 1979; Sharma and Erdman 1988, 1989a). Повышение потребления холина хлорида с 23 до 326 г способствует увеличению содержания холина в двенадцатиперстной кишке с 1,2 до 2,5 г (Sharma and Erdman 1988). Таким образом, для получения положительного эффекта, вводимый в рацион холин должен быть в защищенной от распада в рубце форме.
Для защиты веществ от распада в рубце в основном используется метод микрокапсулирования.
Микрокапсулы могут быть разработаны таким образом, чтобы добавка всасывалась в необходимом отделе кишечника. Это повышает ее эффективность, обеспечивает оптимальную дозировку и расширяет спектр использования кормов и кормовых добавок. В опыте in vitro [Deuchler et al. (1998) при помощи метода Sharma and Erdman (1989a)] и протокола in situ [Varga, при помощи метода Lykos and Varga (1995); Рис. 1] при исследовании несколько микрокапсулированных продуктов, содержащих 28-50% холина хлорида, 85% холина было защищено от распада в рубце. Эти продукты вводили непосредственно в корма.
ОЦЕНКА СТАТУСА ХОЛИНА
Холин, фолаты и витамин В12 являются основными участниками метаболизма углерода – сложных биохимических реакций, принимающих участие в переносе одиночных атомов углерода (Mason 2003). Полная картина статуса холина требует определения этих трех витаминов в плазме, в дополнение к холину и холин-содержащим фософолипидам. Это позволит разрабатывать интегрированные подходы для всех питательных веществ, вовлеченных в метаболизм углерода, и обеспечить более полное определение метилирующей способности организма (Mason 2003).
Исследования, проведенные Pinotti et al. (2004), показывают, что введение 50 г защищенного холина (RPC, 20 г холина хлорида) в рацион коров в переходный период, к концу него, обеспечивает повышение уровня холин-содержащих фосфолипидов (127 против 171 мг дл–1, P = 0,08) и фолатов (6,74 против 9,68 нг мл–1, P < 0,05 ) в плазме крови (20 д в молоке). Эти данные указывают на то, что введение RPC эффективно как в целях повышения уровня доступного холина, так и для оптимизации метаболизма метильных групп: увеличение фолатов в плазме может быть связано с влиянием холина на метаболизм метильных групп. Как было отмечено, холин является важным источником лабильных метильных групп, но при его недостатке, метильные группы синтезируются через систему THF (ресинтез метионина из гомоцистеина) или поступают из других источников. Однако, в системе THF происходит поглощение прекурсоров глюконеогенеза, таким образом, в момент дисбаланса глюкозы (ранний раздой) обнаруживается недостаток этих прекурсоров (Armentano 1994; Rukkwamsuk et al. 1999).
Неожиданной находкой в исследованиях в этой области (неопубликованные результаты Pinotti и соавторов) было то, что концентрации витамина В12 в плазме крови коров, получавших RPC (354 пг мл-1) оказались ниже (Р <0,05), чем у контрольных (543 пг мл-1). Витамин В12 был принят в качестве маркера статуса метильных групп, и полученные низкие концентрации у опытных животных не соответствовали с наблюдаемым увеличением содержания в плазме фолатов и холин-содержащих фосфолипидов. Витамин В12 требуется как коэнзим для синтеза метионина из гомоцистеина и для глюконеогенеза из пропионата. Повышение глюконеогенеза, таким образом, может снижать содержание витамина В12, и как показывают исследования, приводить к увеличению концентрации глюкозы в плазме коров, получавших RPC (Р=0,06).
ис 1. Распад защищенного холина (50% холина хлорида) в рубце в зависимости от времени (определение по методу Lykos and Varga (1995), представлено д-м G. Varga).
Содержание холина в молоке является хорошим методом определения статуса холина у жвачных. Deuchler et al. (1998), при измерении содержания холина в молоке коров в середине лактации, обнаружил, что его концентрации были выше в молоке коров, получавших RPC или инъекции холина (91 мг л-1 и 116 мг л-1, соответственно, против 72-86 мг л-1 в контрольной группе). Это говорит о зависимости его уровня в молоке от содержания в организме и биодоступности. Это исследование также показывает, что выделение холина с молоком составляет около 2 г д-1.
Pinotti et al. (2003) в своем опыте исследовал секрецию холина с молоком коров в переходный период. Средняя концентрация холина в молоке коров, получавших RPC, составляла 138, 5 мг кг-1 против 99,66 мг кг-1 в контрольной группе (повышение на 39%), в то время как общая секреция холина была 3,81 г д-1 и 2,53 г д-1, соответственно. На основании увеличения холина в молоке коров из опытной группы, было рассчитано восстановление введенного холина – 6%. Это соответствует данным Deuchler et al. (1998) и подтверждает всасывание защищенного холина, и то, что выделение его с молоком зависит от концентрации в организме и биодоступности.
Необходимо отметить, что концентрации холина в молоке также зависят от породы, состава жиров, размера молекул жира, стадии лактации и метода определения. Кроме того, несмотря на то, что содержание в молоке холина рассматривается как индикатор доступности холина, после прохождения рубца, все еще не ясно, какая именно фракция (свободный холин, холин-содержащие фосфолипиды, или обе) зависит от введения его в рацион.
МОЛОКО И МЕТАБОЛИЗМ
Несмотря на то, что потребность молочного скота в холине не известна (NRC 2001), высокая его доступность (путем введения в корм RPC) может оказывать благоприятное влияние на молочную продуктивность (Erdman and Sharma 1991; Hartwell et al. 2000; Scheer et al. 2002; Pinotti et al. 2003; Piepenbrink and Overton 2003). Как выяснилось, биодоступность холина у молочных коров ограничена (Sharma and Erdman 1989b; Erdman and Sharma
1991), и зависит от таких факторов, как дозировка, способ введения, стадия лактации и состав основного рациона.
В отношении дозировки, хорошие удои получают при 12-29 г д-1 защищенного холина (хлорида). На рисунке 2 представлено взаимоотношение между уровнем введения и удоями, рассчитанное по результатам нескольких исследований. Эти дозировки довольно высокие, но известно, что в рационах млекопитающих, холина требуется гораздо больше, чем водорастворимых витаминов (г против мг) (McDowell 1989).
Способ введения также важен. В большинстве исследований, RPC вводили в качестве кормовой добавки (Hartwell et al. 2000; Scheer et al. 2002; Pinotti et al. 2003; Piepenbrink and Overton 2003). В первом опыте, Pinotti et al. (2003), наблюдал значительное увеличение удоев (2,9 кг д-1) при даче 20 г д-1 защищенного холина в течение первых 30 дней лактации. Во втором опыте, (Pinotti et al. 2004), при той же дозировке, но при введении в составе готового корма в течение первого месяца лактации наблюдалась только тенденция к повышению удоев (25,10 против 27, 05 в контрольной и опытной группах¸ соответственно (Р=0,06)). Эти различия вероятно связаны с влиянием различных способов введения. Во втором опыте, потребление холина перед отелом и после составляло 92 и 84% от введенного количества, соответственно. И, напротив, в первом опыте, потребление составляло 100%. Таким образом, во втором опыте, потребление холина в первый месяц лактации (повышенная потребность в метильных группах) была ниже, чем в сухостойный период.
В отношении стадии лактации, наивысшая потребность в метильных группах наблюдается во время раздоя, с тем предположением, что у молочных коров дефицит холина. Также считается, что на этой стадии доступность других питательных веществ (фолатов, метионина и витамина В12) обычно низкая (Girard 2002). Так как холин является липотропным фактором, он может быть очень необходим в это время с точки зрения изменения метаболизма в печени, происходящего при переходе из поздней стельности к ранней лактации (Piepenbrink and Overton 2000). Описана взаимосвязь между введением холина и концентрациями в плазме крови неэтерифицированных жирных кислот (NEFA) и соотношения NEFA/холестерин в плазме (Pinotti et al. 2003). Это говорит о том, что увеличение в плазме NEFA, связанное с мобилизацией жира при отеле, в опытной группе ниже, чем в контрольной. В дальнейших исследованиях (Pinotti et al. 2004) были получены схожие результаты. NAFA в плазме у коров из опытной группы, снижались с 0,70 ммоль л-1 до 0,58 ммоль л-1 (-18%) к 20 дню лактации. Мобилизация NEFA приводит к увеличению накопления в печени, где эти жирных кислоты подвергаются окислению до кетоновых тел или диоксида углерода, или этерификации до триглицеридов. Холин выступает донором метила при синтезе карнитина, необходимого для окисления жирных кислот. Тенденция к снижению (-30%) концентрации β-гидроксибутирата в плазме крови коров, получавших RPC (Pinotti et al. 2004), поддерживает утверждение о роли холина в метаболизме жирных кислот. Chung et al. (2005) обнаружил, что RPC обладает доза-зависимым влиянием на снижение концентраций NEFA, у коров, получавших 25 г и 50 г, на 11% и 23% соответственно.
Эти результаты и предполагаемые механизмы соответствуют данным, полученными Piepenbrink and Overton (2003), где дача RPC в после отельный период способствовала снижению накопления в печени NEFA (внутриклеточные продукты этерирфикации) и увеличению содержания в ней гликогена.
Введение в рацион холина влияет на содержание белка и доступность других компонентов кормов (NRC 2001). Они в свою очередь влияют на эффективность холина. Hartwell et al. (2000) обнаружил, что введение 12 г д-1 RPC, начиная с 28 дня после отела, способствует повышению удоев (+2,6 кг) в течение 8 недель лактации. Это вероятно было связано с частичным снижением влияния холина на катаболизм метионина в начале лактации, когда метильные группы требуются для синтеза холина (Emmanuel and Kennelly 1984). Также было выяснено, что повышенная доступность (после инфузии) метилированных соединений, включая холин (холин и креатин), снижает у овец необратимую потерю метионина, что предположительно связано с введением дополнительных источников метильных групп (Lobley et al. 1996). Scheer at al. (2002) исследовал взаимодействие между холином, компонентами кормов и источниками белка. Было обнаружено, что введение RPC (15 г д-1) способствует повышению содержания белка в молоке, увеличению удоев, в случае, если коровы в переходный период не получают сою. Таким образом, можно сделать вывод, что введение в рацион холина является не всегда достаточным для повышения молочной продуктивности. Теоретически, потребность в холине может компенсироваться за счет других питательных веществ, но на практике это встречается редко.
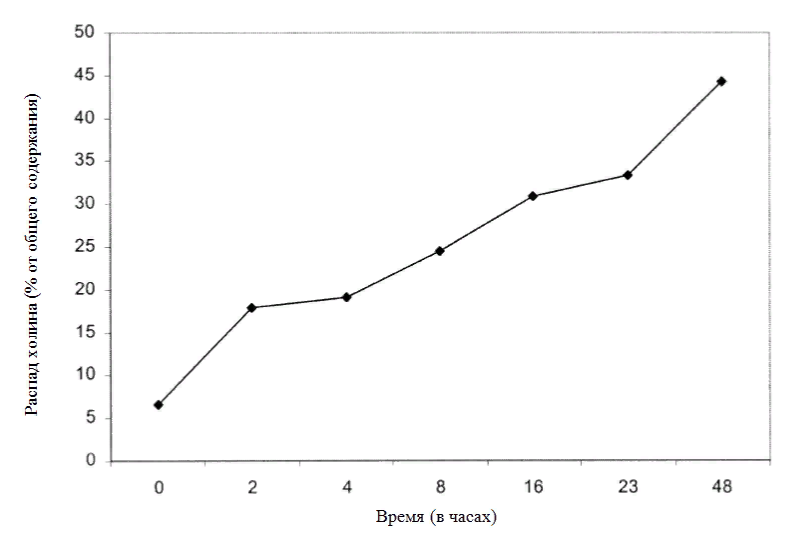
Рис. 2. Соотношение между количеством RPC в корме (от 6 до 60 г на корову в день) и повышению удоев. Объединенные данные: (ES) Erdman and Sharma (1991); (E) Erdman (1994); (H) Hartwell et al. (2000); (S) Scheer at al. (2002);
(P1) Pinotti et al. (2003); (P2) Pinotti et al. (2004); (PO) Piepenbink and Overton (2003).
ХОЛИН И АЛЬФА-ТОКОФЕРОЛ
Было выявлено, что концентрации α-токоферола в плазме и соотношение α-токоферол/холестерин после отела, у коров, получавших RPC, выше, чем в контрольной группе (Pinotti et al. 2003 and 2004, Рис. 3). Это соотношение α-токоферол/холестерин является новым открытием, несмотря на то, что Koo and Noh (2001) была описана вероятная важность гидролиза фосфатидилхолина в увеличении всасывания α-токоферола в кишечнике крыс. Перед отелом происходит значительное снижение концентрации витамина Е в плазме крови молочных коров. В течение этого периода очень сложно поддерживать его концентрации на требуемом для здорового животного уровне (Hogan et al. 1993; Weiss et al. 1994; Baldi et al. 2000;
Baldi 2005). Действительно, концентрации витамина Е в плазме коров, получавших RPC, в опытах Pinotti et al. (2003, 2004), после отела снижались, но меньше, чем в контрольной группе. Это незначительное снижение концентрации витамина Е может быть связано, по крайней мере частично, с увеличением абсорбции и переноса жира, вызванным введением холина. Однако, механизмы поддержания холином концентраций витамина Е в плазме крови коров в постотельный период еще не до конца изучены. Это рассматривается как дополнительный плюс к эффективности применения холина.
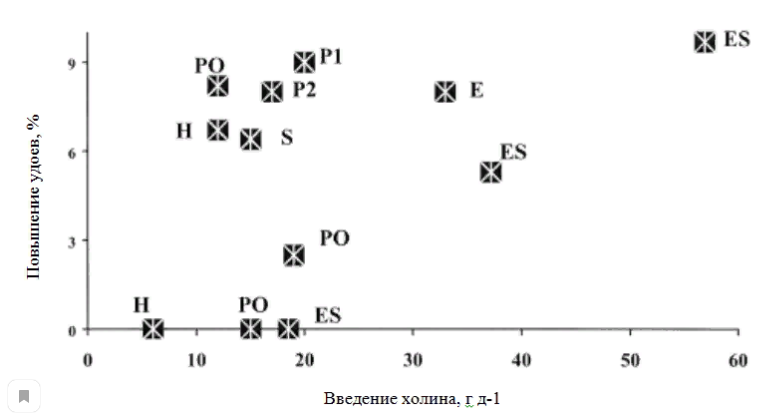
Рис.3. концентрации α-токоферола в плазме коров из контрольной (□) и опытной (■) групп в течение 10 до отела и 20 дней после. Звездочкой отмечено значительное различие (Р<0,05) с контрольной группой. Вертикальные колонки обозначают SEM [Pinotti et al. (2004)].
ЗАКЛЮЧЕНИЕ
Проанализированные в этой статье результаты предполагают, что введение холина может способствовать повышению молочной продуктивности и влиять на метаболизм жиров и метильных групп у молочных коров в переходный период. Однако, эти механизмы окончательно не изучены. Для определения влияния холина на эти процессы требуется проведение большего количества исследований. Кроме того, необходимо более подробное изучение взаимодействия холина с витаминами и питательными веществами.
БЛАГОДАРНОСТЬ
Мы выражаем благодарность за поддержку компании Ascor Chimici. Отдельное спасибо профессору Gabriella Varga из Pennsylvania State University за предоставление данных и внесение правок в раннюю версию статьи. Don Ward корректор версии на английском языке.
ПРИНЯТЫЕ ОБОЗНАЧЕНИЯ:
NEFA – неэтерифицированные жирные кислоты;
RPC – защищенный от распада в рубце холин;
SAH – S-аденозил-гомоцистеин;
SAM – S-аденозил-L-метионин;
THF – тетрагидрофолат.
Armentano, L. 1994. Impact of metabolism by extragastrointestinal tissues on secretory rate of milk proteins. J. Dairy Sci. 77: 2809–2820.
Baldi, A. 2005. Vitamin E in dairy cows. Livest. Prod. Sci. 98: 117–122.
Baldi, A., Savoini, G., Pinotti, L., Monfardini, E., Cheli, F. and Dell’Orto, V. 2000. Effect of vitamin E and different energy sources on vitamin E status, milk quality and reproduction in transition cows. J. Vet. Med. Ser. A 47: 599–608.
Baker, D. H. 1995. Vitamin bioavailability. Pages 399–431 in C. B. Ammerman, D. H. Baker, and A. J. Lewis eds. Bioavailability of nutrients for animals: Amino acids, minerals, and vitamin. Academic Press, London, UK.
Chung, Y.-H., Cassidy, T. W., Girard, I. D., Cavassini, P. and Varga, G. A. 2005. Effects of rumen protected choline and dry propylene glycol on feed intake and blood metabolites of Holstein dairy cows. J. Dairy Sci. 88 (Suppl. 1): 61.
Dawson, R. M. C., Grime, D. W. and Lindsay D. B. 1981. On the insensitivity of sheep to the almost complete microbial destruction of dietary choline before alimentary-tract absorption. Biochem. J. 196: 499–504.
Deuchler, K. N., Piperova, L. S. and Erdman, R. A. 1998. Milk choline secretion as an indirect indicator of postruminal choline supply. J. Dairy Sci. 81: 238–242.
Emmanuel, B. and Kennelly, J. J. 1984. Kinetics of methionine and choline and their incorporation into plasma lipids and milk components in lactating goats. J. Dairy Sci. 75: 2043–2070.
Erdman, R. A. and Sharma, B. K. 1991. Effect of dietary rumenprotected choline in lactating dairy cows. J. Dairy Sci. 74: 1641–1647.
Girard, C. L. 2002. A new look at the requirements of high-producing dairy cows for B-complex vitamins. Pages 237–254 in J. Wiseman and P. C. Garnsworthy, eds. Recent developments in ruminant nutrition 4. Nottingham University Press, Nottingham, UK.
Hartwell, J. R., Cecavqa, M. J. and Donkin, S. S. 2000. Impact of dietary rumen undegradable protein and rumen-protected choline on intake, peripartum liver triacylglyceride, plasma metabolites and milk production in transition dairy cows. J. Dairy Sci. 83: 2907–2917.
Hogan, J. S., Weiss, W. P. and Smith, K. L. 1993. Role of vitamin E and selenium in host defence against mastitis. J. Dairy Sci. 76: 2795–2803.
Kennedy, G. D., Young, P. B., Kennedy, S., Scott, J. M., Molloy, A. M., Weir, D. G. and Price, J. 1995. Cobalt-vitamin B-Koo, S. I. and Noh, S. K. 2001. Phosphatidylcholine inhibits and lysophosphatidylcholine enhances thee lymphatic absorption of α- tocopherol in adult rats. J. Nutr. 131: 717–722.
Kuksis, A. and Mookerjea, S. 1978. Choline. Nutr. Rev. 36: 201–207.
Lykos, T. and Varga, G. A. 1995. Effects of processing method on degradation characteristics of protein and carbohydrate sources in situ. J. Dairy Sci. 78: 1789.
Lobley, G. E., Connell, A. and Revell, D. 1996. The importance of transmethylation reactions to methionine metabolism in sheep: effect of supplementation with creatine and choline. Br. J. Nutr. 75: 47–56.
Mason, J. B. 2003. Biomarkers of nutrient exposure and status in one-carbon (methyl) metabolism. J. Nutr. 133: 941S–947S.
Mato, J. M., Alvarez, L., Corrales, F. J. and Pajares, M. A. 1994. S-adenosylmethionine and the liver. Pages 461–470 in I. M. Arias, J. L. Boyer, N. Fausto, W. B. Jakoby, D. A. Schachter, and D. A. Shafritz, eds. The liver: Biology and pathobiology. Raven Press Ltd., New York, NY.
McDowell, L. R. 1989. Choline. Pages 347–364 in Lee R. McDowell, ed. Vitamins in animal nutrition – Comparative aspect to human nutrition. Academic Press, Inc., New York, NY.
Neill, A. R., Grime, D. W. and Dawson, R. M. C. 1978. Conversion of choline methyl groups through trimethylamine into methane in the rumen. Biochem. J. 179: 529–535.
Neill, A. R., Grime, D. W., Snoswell, A. M., Northrop, A. J., Lindsay, D. B. and Dawson, R. M. C. 1979. The low availability of dietary choline for the nutrition of the sheep. Biochem. J. 180: 559–565.
National Research Council. 2001. Vitamins. Pages 162–177 in Nutrient requirements of dairy cattle. 7th rev. ed. National Academy of Science, Washington, DC.
Piepenbrink, M. S. and Overton, T. R. 2000. Liver metabolism and production of periparturient dairy cattle fed rumen-protected choline. J. Dairy Sci. 83 (Suppl. 1): 257 (Abstr.).
Piepenbrink, M. S. and Overton, T. R. 2003. Liver metabolism and production of cows fed increasing amounts of rumen-protected choline during the periparturient period. J. Dairy Sci. 86: 1722–1733.
Pinotti, L., Baldi, A. and Dell’Orto, V. 2002. Comparative mammalian choline metabolism with emphasis on role in ruminants, especially the high yielding dairy cow. Nutr. Res. Rev. 15: 315–331.
12 deficiency and the activity of methylmalonyl CoA mutase and methionine synthase in cattle. Internat. J. Vit. Nutr Res. 65: 241–247.
Pinotti L., Baldi, A., Politis, I., Rebucci, R., Sangalli, L. and Dell’Orto, V. 2003. Rumen protected choline administration to transition cows: Effects on milk production and vitamin E status. J.
Vet. Med. A 50: 18–21.
Pinotti L., Campagnoli., A., Sangalli, L., Rebucci, R., Dell’Orto, V. and Baldi, A. 2004. Metabolism of periparturient dairy cows fed rumen-protected choline. J. Anim. Feed Sci. 13 (Suppl. 1): 551–554.
Rukkwamsuk, T., Wensing, T. and Geelen, M. J. H. 1999. Effect of fatty liver on hepatic gluconeogenesis in periparturient dairy cows. J. Dairy Sci. 82: 500–505.
Scheer, W. A., Lucy, M. C., Kerley, M. S. and Spain, J. N. 2002.
Effects of feeding soybeans and rumen protected choline during late gestation and early lactation on performance of dairy cows. J. Dairy Sci. 85 (Suppl.1): 276.
Scott, J. M. 1999. Folate and vitamin B12. Proc. Nutr. Soc. 58: 441–448.
Sharma, B. K. and Erdman, R. A. 1988. Effects of high amounts of dietary choline supplementation on duodenal choline flow and production responses of dairy cows. J. Dairy Sci. 71: 2670–2676.
Sharma, B. K. and Erdman, R. A. 1989a. In vitro degradation of choline from selected feedstuffs and choline supplements. J. Dairy Sci. 72: 2771–2776.
Sharma, B. K. and Erdman, R. A. 1989b. Effects of dietary and abomasally infused choline on milk production responses of lactating dairy cows. J. Nutr. 119: 248–254
Weiss, W. P., Hogan, J. S., Smith, K. L. and Williams, S. N. 1994. Effects of dietary fat and vitamin E on α-tocopherol and β- carotene in blood of peripartum cows. J. Dairy Sci. 77: 1422–1429.
Zeisel, S. H. 1988. “Vitamin-like” molecules. Pages 440–452 in M. Shils and V. Young, eds. Modern nutrition and health and disease. Lea and Febiger, Philadelphia, PA.
Zeisel, S. H. 1992. Choline: an important nutrient in brain development, liver function and carcinogenesis. J. Am. Coll. Nutr. 11: 473–481.
Zeisel, S. H. 2000. Choline: An essential nutrient for humans. Nutr. 16: 669–671.
Zeisel, S. H., Da Costa, K., Franklin, P. D., Alexander, E. A., Lamont, J. T., Sheard, N. F. and Beiser, A. 1991. Choline, an essential nutrient for humans. FASEB J. 5: 2093–2098.

